非瘟疫苗最新研究报道:一株人工缺失七个基因的弱毒疫苗研制成功
今日,中国农业科学院哈尔滨兽医研究所在《SCIENCE CHINA Life Sciences》上预发了一篇题为 A seven-gene-deleted African swine fever virus is safe and effective as a live attenuated vaccine in pigs的论文,报道了一种非洲猪瘟弱毒疫苗创制成功,引起业内一片沸腾。

非洲猪瘟(ASF)是猪的一种毁灭性传染病,正严重威胁着全球养猪业。 迫切需要有效的疫苗。 在这里,我们以中国的ASFV HLJ / 18为骨干,并产生了一系列基因缺失的病毒。 在无特定病原体猪,商品猪和怀孕母猪中的毒力、免疫原性、安全性和保护性功效评估中表明,已删除了七个基因的一种病毒,即HLJ / 18-7GD,已在猪中完全减毒,不能转化为强毒株,并为猪提供全面保护,使其免受致命的非洲猪瘟病毒(ASFV)攻击。 该团队研究表明,HLJ / -18-7GD是一种抗ASFV的安全有效疫苗,因此有望在控制ASFV的传播中发挥重要作用。
非洲猪瘟(ASF)是猪的一种毁灭性传染病,对全球养猪业来说是灾难性的。病原体非洲猪瘟病毒(ASFV)属于家族中Asfivirus属。 ASFV的结构复杂,并且根据菌株的不同,包含151-167个基因的大型双链DNA基因组(170-193 kb)。根据编码衣壳蛋白p72的B646L基因,ASF被分为24种不同的基因型,所有这些基因型都已在非洲检测到。 ASFV基因型中的两种已经传播到其他大陆。 I型ASFV基因型在1950年代在欧洲出现,并在1990年代中期从大多数欧洲国家根除。 II型ASFV基因型于2007年被引入佐治亚州,此后在许多欧洲国家流行。在2018年,该病毒被传播给了中国和其他10个亚洲国家的猪。
中国的生猪产量占全球生猪总数的50%以上;但是,中国有超过99%的养猪场是小型养猪场,每年只生产500头以下的生猪,而且这些养猪场通常没有生物安全措施。尽管ASF的暴发似乎是通过宰杀受感染的猪来控制的,但ASFV却广泛污染了环境,因此继续对中国的养猪业构成威胁。由于没有疫苗,恢复生猪生产不太可能成功。与2018年8月相比,2019年9月中国的生猪产量减少了40%,自2019年8月以来猪肉价格翻了一番。其他亚洲国家的情况可能与此类似。这些事实表明,不能仅通过剔除感染的猪来控制ASF,因此迫切需要开发和应用有效的疫苗。
在过去的几十年中,已经评估了针对ASF的不同疫苗策略。已对灭活疫苗,DNA疫苗,亚单位疫苗和腺病毒载体疫苗进行了测试,并证明不成功。一些基因缺失的ASFV已显示出作为减毒活疫苗的潜力,但尚不清楚它们在猪中复制过程中是否能转化为更具毒性的菌株。在本研究中,我们选择了中国第一个分离出的ASFV,猪/黑龙江/ 2018(HLJ / 18)作为开发减毒活疫苗的骨架。
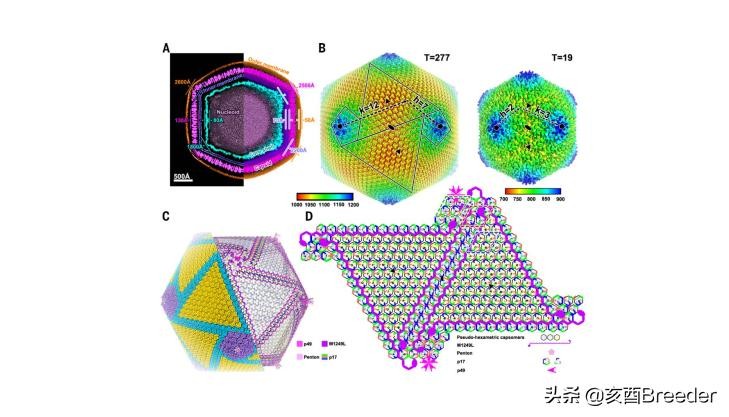
结果显示:具有不同基因缺失的ASFV的产生和毒力评估使用DNA同源重组技术,我们通过删除编码1至7种不同蛋白的基因片段(包括MGF505- 1R,MGF505-2R,MGF505-3R,MGF360-12L,MGF360-13L,MGF360-14L,CD2v,9GL,DP148R和UK,以前已证明对不同ASFV的毒力很重要。带有一个或两个报告基因GFP和mCherry的基因缺失病毒在原代猪肺泡巨噬细胞(PAM)中纯化,经序列分析确认,命名为HLJ / 18-6GD(编码六种蛋白MGF505-1R的基因, MGF505-2R,MGF505-3R,MGF360-12L,MGF360-13L和MGF360-14L已删除),HLJ / 18-CD2v-del(已删除编码CD2v的基因),HLJ / 18-DP148R-del(已删除DP148R基因), HLJ / 18-9GL&UK-del(删除9GL和UK基因),HLJ / 18-CD2v&UK-del(删除CD2v和UK基因)和HLJ / 18-7GD(编码MGF505-1R,MGF505-2R,MGF505-3R的基因) ,MGF360-12L,MGF360-13L,MGF360-14L和CD2v已删除)(图1A)。
图-1
图1:不同基因缺失的非洲猪瘟病毒(ASFV)的产生和毒力评估。 A,每个基因缺失的ASFV中缺失的基因和区域的示意图。 如所示,用p72eGFP,eGFP或p72mCherry报道基因盒替换缺失的基因区段。 在面板的右侧显示了表达不同荧光的病毒感染的初级猪肺泡巨噬细胞。 指出了指示相对于ASFV HLJ / 18基因组的缺失边界的核苷酸位置。 B,用野生型ASFV HLJ / 18和不同基因缺失的ASFV接种的猪的存活率。
HLJ / 18病毒在猪中具有高度致死性,其50%的猪致死剂量(PLD50)为1.7 50%的吸血剂量(HAD50)(图1B)。为了研究这些基因删除的病毒是否在猪中减毒,我们给三到六只7周龄无SPF的猪肌肉注射了103和105 TCID50的基因删除病毒,并观察了这些猪三个星期。接种后21天(p.i.)监测体温和存活率。如图1B所示,所有接种HLJ / 18-DP148R-del的猪都发烧并在感染后9天内死亡,接种HLJ / 18-CD2v-del或HLJ / 18-CD2v&UK的猪中有50%–100% -del发生发烧,这些组中有50%-75%的猪在3周观察期内死亡,而所有接种HLJ / 18-6GD,HLJ / 18-9GL&UK-del或HLJ / 18- 7GD保持健康,并在3周的观察期内存活下来(图1B,表1)。这些结果表明,HLJ / 18-DP148R-del在猪中具有致死性,HLJ / 18-CD2v-del和HLJ / 18-CD2v&UK-del在猪中略有减弱,HLJ / 18-6GD,HLJ / 18-9GL&UK-在猪中,del和HLJ / 18-7GD显着减弱。
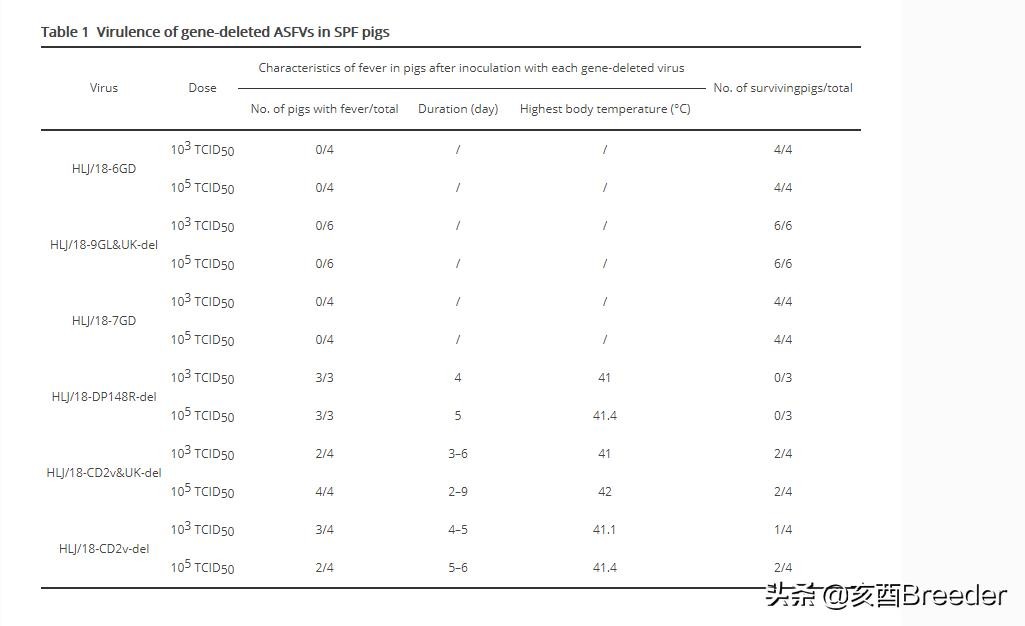
表1
减毒的ASFV对猪的强效HLJ / 18攻击的保护作用:
为了研究减毒病毒是否能够诱导保护性免疫,对HLJ / 18-6GD-,HLJ / 18-9GL&UK-del-和HLJ / 18-7GD接种的猪进行了肌内攻击(im),使用200 PLD50的HLJ / 18病毒;以与对照组类似的方式攻击了四只10周龄的SPF猪。每天记录体温和存活21天。收集死猪的血液,器官和组织,包括心脏,肺,脾,扁桃体,胸腺和五个淋巴结(肠淋巴结,腹股沟淋巴结,上颌下淋巴结,支气管淋巴结和胃肝淋巴结)。来自存活的猪,在攻击后第21天(pc)对动物进行安乐死以通过qPCR进行病毒DNA定量。对照组和HLJ / 18-9GL&UK-del接种组中的猪都发烧并在p.c.12天内死亡。 (图2A);在这些猪的血液,器官和组织中检测到高拷贝的病毒DNA(图2B和C)。接种了HLJ / 18-6GD和HLJ / 18-7GD的猪均在观察期内存活(图2A)。在这些组的猪的某些器官或组织中检测到病毒DNA(图2D和E)。值得注意的是,接种HLJ / 18-7GD组的病毒DNA拷贝数低于其他组。接种103 TCID50和105 TCID50 HLJ / 18-6GD的每组中的一只猪发烧分别持续9天和6天(表2)。 103 TCID50 HLJ / 18-7GD接种组中的所有四头猪发烧,但105 TCID50 HLJ / 18-7GD接种组中只有一头猪发烧1天(表2)。这些结果表明,HLJ / 18-9GL&UK-del不诱导任何保护作用,而HLJ / 18-6GD和HLJ / 18-7GD具有免疫原性,能够保护猪免于致命的ASFV攻击。这些数据还表明,HLJ / 18-7GD诱导的保护作用与剂量有关,而HLJ / 18-6GD诱导的保护作用与剂量无关。
图2
不同基因缺失的猪瘟病毒对猪的保护作用。 用致死性ASFV HLJ / 18肌内(i.m.)攻击接种了103或105 TCID50所示基因缺失的ASFV的无特定病原体的猪。 指定的样品是从死猪或存活的猪中收集的,这些猪在攻击后第21天被安乐死以检测病毒DNA。 A,猪的成活率。 B–E,对照组,HLJ / 18-9GL&UK-del接种组,HLJ / 18-6GD接种组和HLJ / 18-7GD接种组中猪的病毒DNA检测。 虚线表示检测下限。 红色星号表示未从夜间死亡的猪中采集一些血液样本。
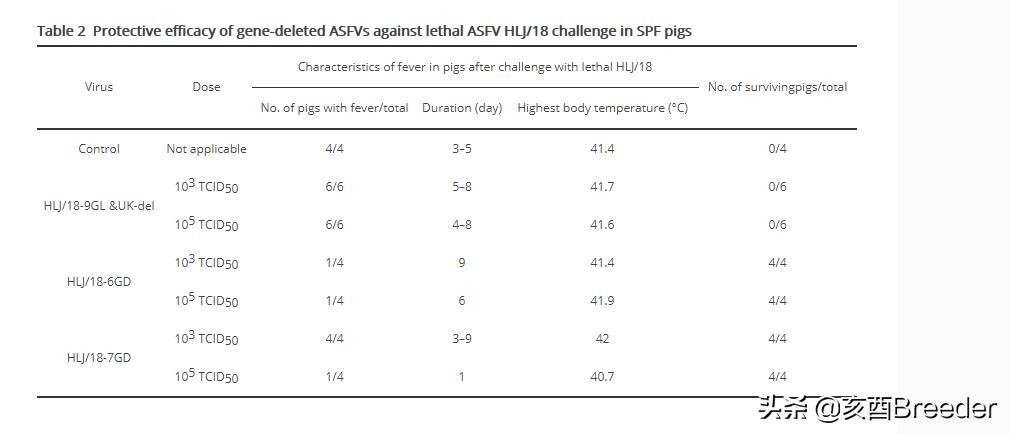
表2
HLJ / 18-6GD和HLJ / 18-7GD在猪中的安全性评估:
减毒活疫苗的最大关注点是疫苗种子病毒是否可以在接种动物的复制过程中转化为强毒株,因为两种早期的活疫苗是通过细胞培养中的连续传代或从自然分离得到的弱毒株而开发的。无毒力的菌株,在1960年代在葡萄牙和西班牙的养殖猪中使用时,转化为致死性菌株,造成了10%至50%的死亡率。根据中国减毒活疫苗开发指南,必须在目标动物中连续传播疫苗株5代,以评估适应动物的种子株是否能够复制比原始种子菌株更有效或更致命。为此,对六只SPF猪的组肌肉内接种107 TCID50的HLJ / 18-6GD和HLJ / 18-7GD病毒,并观察21天。在每天第5、10和15天从猪中采集血样。在第21天p.i.处死安乐死的每只猪,收集脾脏和淋巴结。通过qPCR检测病毒DNA。在接种了HLJ / 18-6GD的组中,在5头猪的血液和1头猪的脾脏中检测到病毒DNA(表3)。但是,在接种HLJ / 18-7GD的组中,在收集的任何样品中均未检测到病毒DNA(表3)。所有猪都存活了3周的观察期。
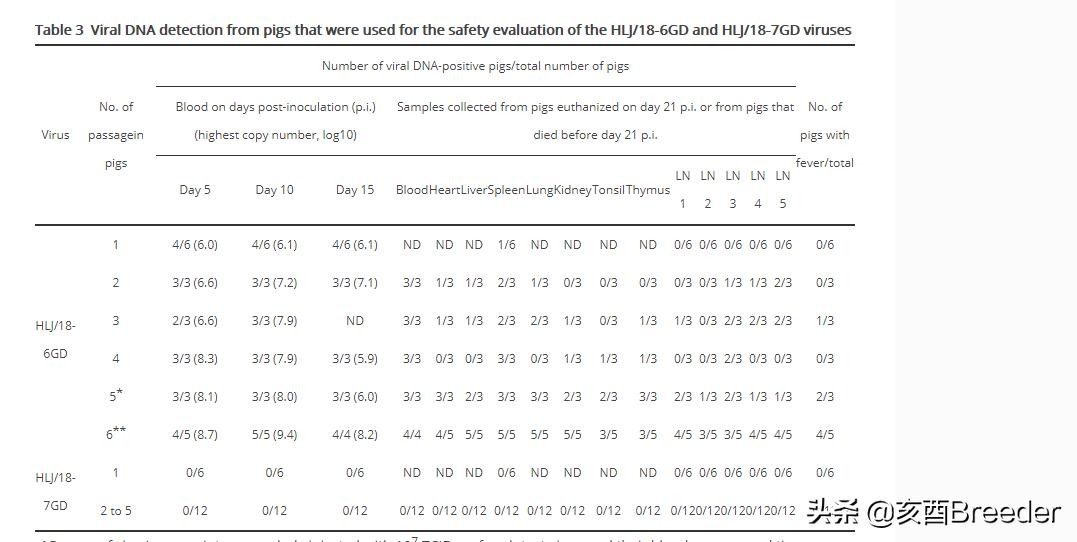
表3
接下来,我们在猪中又通过了HLJ / 18-6GD阳性血液四次传代。在第5天,第10天和第15天再次采血,并在第21天对每只猪实施安乐死,包括心脏,肝脏,脾脏,肺,肾,扁桃体,胸腺和淋巴结在内的器官和组织。收集用于检测病毒DNA。我们发现HLJ / 18-6GD病毒在猪中逐渐更有效地复制,这可以通过用第5代病毒接种的猪血液中的病毒DNA拷贝数量增加和组织分布来证明(图3A–D,表3)。 。值得注意的是,第5代中HLJ / 18-6GD病毒的一只猪发展成严重疾病,并在p.i第11天死亡。 (图3F,表3)。在p.i. 5天采集的血液从该猪中再接种5头猪,所有这些猪(第6代)的血液和器官均具有高病毒DNA拷贝,其中四只发烧,其中一只表现出严重的疾病症状并在下午13点死亡。 (图3E和F,表3)。这些结果表明,HLJ / 18-6GD病毒在猪中复制过程中可能具有更高的毒性。
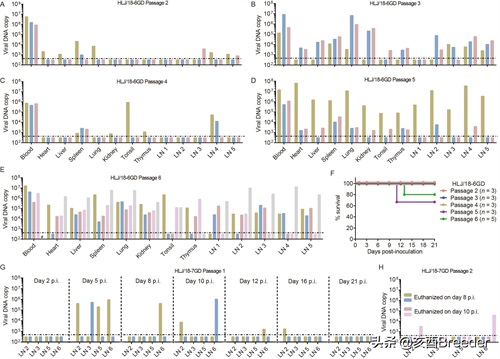
图3
HLJ / 18-6GD和HLJ / 18-7GD在猪中的安全性评估。 HLJ / 18-6GD和HLJ / 18-7GD在猪中连续通过,并从死后的猪或存活的猪(在接种后第21天安乐死)的指定样本中收集病毒DNA进行检测。第2至第6代的病毒HLJ / 18-6GD DNA拷贝分别在图A至E中显示。 F组显示了接种不同代次HLJ / 18-6GD的猪的成活率。从最初接种HLJ / 18-7GD的猪或盲目通过的猪收集的任何样品中均未检测到病毒DNA(表3)。因此,对14头猪接种了107.7 TCID50剂量的HLJ / 18-7GD疫苗,并在第2、5、8、10、12、16和21 pi的每个时间点对2头猪实施了安乐死,并在少数情况下检测到病毒DNA。某些猪的淋巴结(G),以及第二次传代后(H)的一只猪的两个淋巴结,但在血液,心脏,肝脏,脾脏,肺,肾,扁桃体,胸腺或其他淋巴中未检测到任何猪的节点(数据未显示)。虚线表示检测下限。 LN 1:肠淋巴结; LN 2:腹股沟淋巴结; LN 3:上颌下淋巴结; LN 4:支气管淋巴结; LN 5:胃肝淋巴结; LN 6:纵隔淋巴结。
我们还盲目通过了接受HLJ / 18-7GD感染的猪的病毒DNA阴性血液四次传代,但从这些猪收集的任何样品中均未检测到病毒DNA(表3)。为了进一步研究HLJ / 18-7GD在猪中的复制,对14只7周龄SPF猪接种了更高剂量的107.7 TCID50病毒,并在第2、5、8、10天对两只猪实施了安乐死,分别为12、16和21 pi。收集这些猪的血液和器官以进行病毒DNA检测。如图3所示,在任何猪的血液,心脏,肝脏,脾脏,肺,肾,扁桃体或胸腺中均未检测到病毒DNA,但在一到两天对这些动物实施安乐死的淋巴结中检测到了病毒DNA。 5、8、10、12和16 pi (图3G)。将具有最高病毒DNA拷贝数的淋巴结匀浆并接种到另外四头猪中,并在p.i第8天对两只猪实施安乐死。其余10只在术后第10天安乐死。收集这些猪的血液,器官和淋巴结以进行病毒DNA检测。如图3H所示,在一只猪的两个淋巴结中检测到病毒DNA,该DNA在p.i. 10天被安乐死,但是在从其他三只猪收集的任何样品中均未检测到(图3H)。在随后接种了病毒DNA阳性淋巴结匀浆的任何随后的猪中均未检测到病毒(数据未显示)。这些结果表明,肌肉注射后,HLJ / 18-7GD病毒仅在猪的某些淋巴结中维持了很短的时间,而在猪的血液或任何其他器官中没有出现。因此,HLJ / 18-7GD在猪中复制期间极不可能转化为强毒株。基于这些安全性评估,我们选择了HLJ / 18-7GD病毒作为ASF的疫苗株,并在干净的商业猪中进行了其他研究。
HLJ / 18-7GD对商品猪的毒性HLJ / 18攻击的保护作用:
由于单剂疫苗诱导的保护性免疫可能会在几周后下降,因此在实际的动物疾病控制实践中可能需要第二剂。除了肌内攻击外,我们还评估了口服挑战猪的保护作用,因为口服途径是自然界中猪主要感染ASFV的方式。将一组来自当地农场的7周龄小猪转移到P2设施中,用105 TCID50的疫苗接种一次或两次(间隔3周),然后在不同的时间点转移到P4设施进行攻击接种疫苗后。将四到五只相似的未接种疫苗的猪作为对照组。用致死性HLJ / 18病毒攻击后,观察所有猪三周。于第21天安乐死的死猪和成活猪的样本,包括血液,心脏,脾脏,肺,扁桃体,胸腺和淋巴结。收集用于qPCR的病毒DNA检测。值得注意的是,所有攻击研究中的对照猪均在攻击后11天内死亡,并且在这些猪的所有测试器官中检测到高病毒DNA拷贝数(图4,表4)。
HLJ / 18-7GD在商业猪中的疫苗效力。 用105 TCID50(A,B,C)或106 TCID50(D)的LJL / 18-7GD疫苗对每组干净的商品猪进行一次(A,D)或两次(B,C)接种,然后在指定的时间进行攻击 肌肉内(im)(A,B,D)或口服(C)致命HLJ / 18病毒的时间点; 使用类似的未接种大龄猪作为对照。 攻击后21天观察猪,然后安乐死以检测挑战性病毒的病毒DNA。 面板上显示了猪器官和组织中的存活率和病毒DNA拷贝。 虚线表示检测下限。 红色星号表示未从夜间死亡的猪中采集一些血液样本。 LN 1:肠淋巴结; LN 2:腹股沟淋巴结; LN 3:上颌下淋巴结; LN 4:支气管淋巴结; LN 5:胃肝淋巴结; LN 6:纵隔淋巴结。
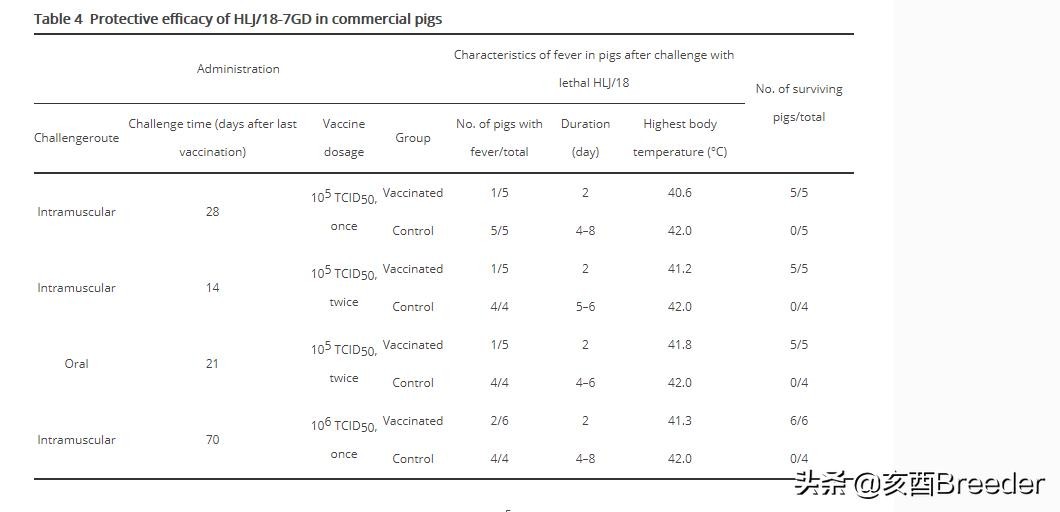
如图4A所示,用一剂105 TCID50疫苗接种猪,并对其进行i.m攻击。疫苗接种后第28天,HLJ / 18的PLD50为200时,全部存活了3周,但在5头结束时被安乐死的五头猪之一的血液,扁桃体和两个淋巴结中检测到病毒DNA观察期(图4A),表明HLJ / 18-7GD在种猪和SPF猪中提供了相似的保护。
两组猪分别用105 TCID50的疫苗接种两次:一组在当天早晨接受攻击。第二次免疫后两周用200 PLD50的HLJ / 18口服,另一组在第二次免疫后三周用106.5 HAD50的HLJ / 18口服。所有接种疫苗的猪都存活了3周的观察期,并且在当天下午在一只猪的一个淋巴结中检测到非常低的病毒DNA水平。挑战组(图4B);在口服激发组中的任何猪中均未检测到病毒DNA(图4C)。这些结果表明,用105 TCID50 HLJ / 18-7GD进行两次免疫接种可为猪提供致命的HLJ / 18致死保护。
商业猪通常饲养至少五个月。当我们对一组在五个月大时(上次接种疫苗后80天)用105 TCID50 HLJ / 18-7GD疫苗接种过两次的猪进行攻击时,我们发现其中80%的猪在攻击中存活了下来,但免疫力持久无法有效清除具有挑战性的病毒(支持信息中的图S1)。图2中的数据表明HLJ / 18-7GD诱导的保护与剂量有关,因此,我们调查了较高的接种剂量是否可以诱导更好的长期保护。为此,我们给六头猪接种了一组106 TCID50剂量的疫苗,并在接种后10周对猪进行了攻击。我们发现,所有接种疫苗的猪都保持健康,并在观察期内存活下来,并且在两只不同猪的一个淋巴结中检测到低水平的病毒DNA,而在其他四只猪中未检测到(图4D)。这些结果表明,单剂量106 TCID50的HLJ / 18-7GD诱导的持久免疫力可提供针对致命ASFV攻击的可靠保护,并建议适当给药两次HLJ / 18-7GD的106 TCID50可以保护猪一生。
妊娠母猪HLJ / 18-7GD的安全性评价:
实际上,为了控制ASF,母猪也需要接种疫苗。 疫苗接种总是有可能在怀孕中引起问题。 因此,我们研究了该疫苗在怀孕母猪中的安全性。 在106头HLJ / 18-7GD TCID50中接种了6头不同孕期的初生母猪:在妊娠第35天(早孕)接种了一头母猪,在妊娠第94天(妊娠后期)接种了两只母猪, 在妊娠的第63天(妊娠中期)接种三头母猪。 留下两只母猪未经处理作为对照(表5)。 从接种当天到分娩后的四个星期,每天对怀孕的母猪进行监测。 接种后所有母猪均保持健康,并在预期日期交付仔猪(表5),这表明接种HLJ / 18-7GD不会对怀孕母猪造成疾病或流产或影响仔猪的健康。
表5
讨论:
已确认ASFV的几个基因与毒力有关,缺乏这些基因的病毒已被评估为潜在疫苗,但没有一个已被全面评估安全性。删除DP148R基因可降低猪中贝宁97/1分离株(I型基因病毒)的毒力,但删除DP148R基因不会减弱HLJ / 18病毒。 CD2v基因的缺失在体内高度减弱了毒性BA71株(基因型I病毒),但在本研究中略微减弱了HLJ / 18病毒;然而,最近的一项研究报道,CD2v基因的缺失并未减弱Georgia / 2010株(基因型II株)。另一项研究报道,删除了9GL和UK基因的ASFV Georgia / 2007(一种基因型II株)是安全且受保护的猪,免受同源病毒攻击;但是,具有相似缺失的HLJ / 18病毒(HLJ / 18-9GL&UK-del)在猪中减毒,但没有提供针对同源病毒攻击的任何保护作用。这些发现表明,ASFV毒力的分子基础可能在菌株之间有所不同,并且在一种菌株中,由一种ASFV菌株的基因缺失引起的生物学变化可能与其他菌株不同。
类似于ASFV Georgia / 2007和Benin 97/1的发现,我们删除了MGF360和MGF505基因的HLJ / 18-6GD也被减弱了在猪和受保护的猪中免受强毒父母病毒的攻击;但是,我们的安全性评估数据表明HLJ / 18-6GD转化为强毒株的风险很高,因此不应用作疫苗。幸运的是,对于HLJ / 18-7GD病毒,已通过删除CD2v基因消除了这种风险。
先前的研究表明,ASF疫苗在适应细胞系后很容易丧失免疫原性,并且无法赋予猪抵御同源病毒攻击的保护作用,表明应当在原代细胞中生产ASF疫苗,这可能会限制大规模生产。据报道,猪骨髓(PBM)细胞支持ASFV复制(。我们发现PBM可以很好地支持HLJ / 18-7GD的生长,并且可以从一只SPF仔猪的PBM产生至少200,000剂疫苗(106 TCID50 /剂量)。此外,我们发现HLJ / 18-7GD在PBM中连续传6代后仍保持其免疫原性(数据未显示)。因此,使用主要PBMs大规模生产HLJ / 18-7GD是可行且具有成本效益的。
综上所述,我们以中国ASFV HLJ / 18为骨干,产生了6个具有不同基因缺失的病毒,发现具有7个基因缺失的HLJ / 18-7GD在猪中被完全减毒,转化风险低。产生强毒株,并可能在猪中诱导出对致命ASFV攻击的坚固保护。 HLJ / -18-7GD已经过全面评估,并被证明对ASFV安全有效。因此,我们希望这种疫苗在控制ASFV中起重要作用。